黄志权、许小丁教授团队开发新型细胞外囊泡支架蛋白, 为肿瘤免疫治疗提供新策略
论文题目:Extracellular vesicle surface display of αPD-L1 and αCD3 antibodies via engineered late domain-based scaffold to activate T-cell anti-tumor immunity.
通讯作者:黄志权;许小丁;黄子贤
第一作者:陈睿;康梓钦;李文昊
论文发表刊物:Journal of Extracellular Vesicles

【研究背景】
细胞外囊泡(EVs)是细胞来源的纳米级颗粒,因其具有可编程性、免疫原性低以及组织渗透性强等优点,EVs正被积极研究作为下一代药物递送载体。基因工程化细胞外囊泡指的是将感兴趣的货物蛋白与高分选至EVs中的支架蛋白相融合,从而生成含有目的货物蛋白的EVs。鉴定及开发高分选至EVs中的支架蛋白,可有效提高目的蛋白的装载效率,提高工程化EVs的治疗效果。
【主要发现】
在EVs的生物发生过程中,内吞体分选及转运复合体家族蛋白(ESCRTs)广泛参与细胞外囊泡的分选、转运及其分泌过程。有趣的是,病毒可利用其晚期结构域(Late domain)挟持ESCRTs家族蛋白相关蛋白,促进其从宿主细胞中出芽释放。受启发于病毒出芽及EVs生成释放的相似性,该研究构建了基于嵌合病毒晚期结构的合成支架蛋白LEAP。LEAP可通过ESCRT通路依赖的方式被高效分选至EVs中,LEAP支架蛋白可兼容多种单链抗体(scFv),将靶向肿瘤相关抗原(如PD-L1、EGFR、CD19)的scFv与LEAP支架蛋白相融合并表达至HEK293T细胞后,其衍生的EVs可靶向结合至表达相应抗原的靶细胞。
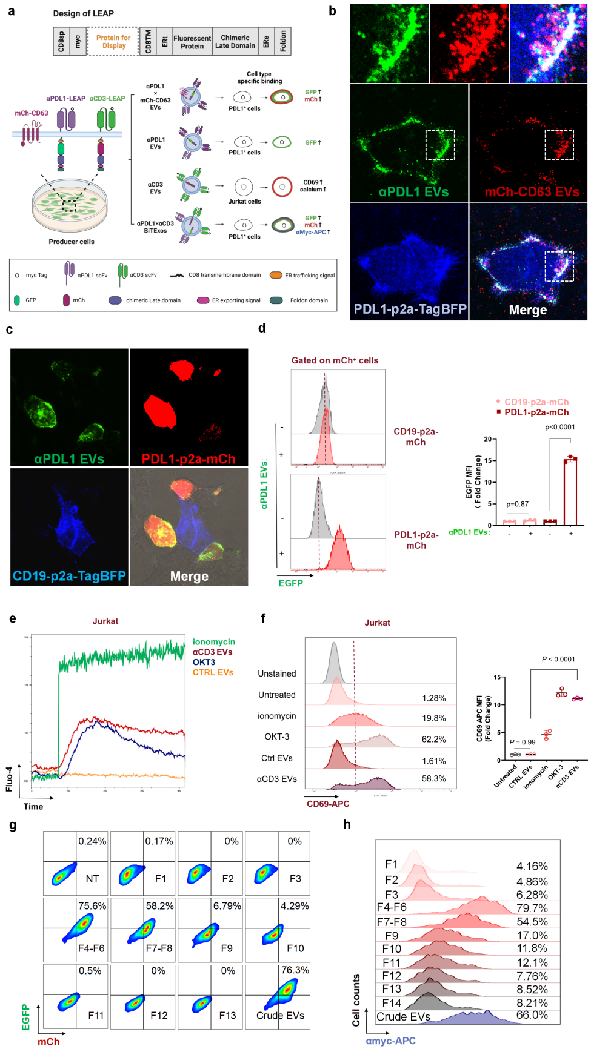 |
(图注:LEAP支架蛋白将PD-L1抗体和CD3抗体展示在EVs表面)
通过LEAP支架蛋白在EVs表面同时展示PD-L1抗体和CD3抗体,可将EVs重编程为双特异性T细胞衔接器,研究人员将其命名为双特异性T细胞衔接细胞外囊泡(αPD-L1×αCD3 BiTExos)。研究显示,αPD-L1×αCD3 BiTExos可通过αPD-L1臂结合PD-L1+肿瘤细胞,并通过CD3臂结合T细胞,从而将T细胞与PD-L1+肿瘤细胞衔接在一起,并通过CD3通路诱导T细胞活化、增殖和杀伤性因子的分泌,从而特异性地杀伤PD-L1+肿瘤细胞。在荷瘤小鼠模型中,αPD-L1×αCD3 BiTExos可促进T细胞在肿瘤微环境中的浸润,诱导杀伤性因子的分泌释放,有效激活T细胞抗肿瘤免疫。
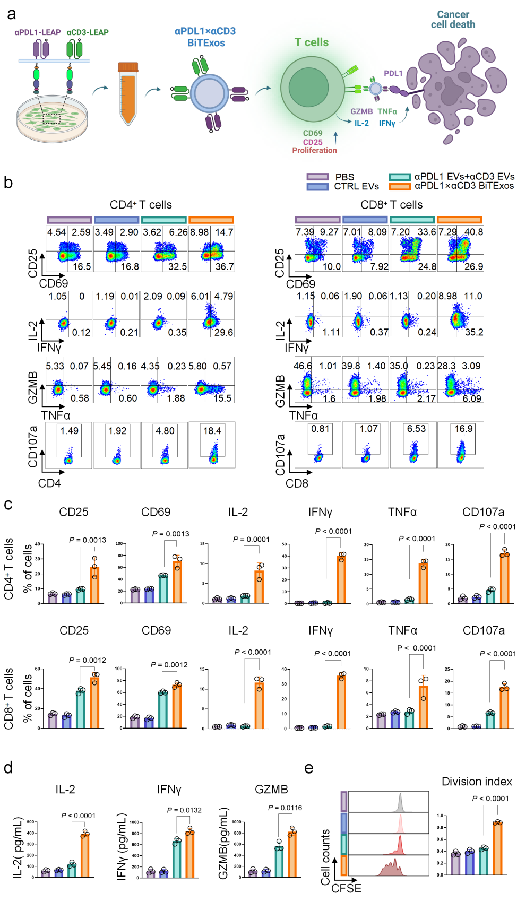 |
(图注:αPD-L1×αCD3 BiTExos有效激活T细胞抗肿瘤免疫)
【研究意义】
这项研究为工程化EVs在肿瘤免疫治疗中的应用提供了新的策略。同时,合成LEAP支架蛋白可作为EVs表面展示平台,有望应用于多种基于EVs的生物医学应用之中。
【论文链接】
https://isevjournals.onlinelibrary.wiley.com/doi/10.1002/jev2.12490
【阅读二维码】








 粤公网安备 44010402003003号
粤公网安备 44010402003003号 