放射科沈君教授团队发现基于超分子有机金属笼构建MR可视化纳米体系可以实现双气体免疫治疗动脉粥样硬化,相关研究成果在Small杂志发表
论文题目:Codelivery of Dual Gases with Metal-Organic Supramolecular Cage-Based Microenvironment-Responsive Nanomedicine for Atherosclerosis Therapy.
通讯作者:沈君等
第一作者:李东野等
论文发表刊物:Small

【研究背景】
动脉粥样硬化(AS)易损斑块持续进展会诱发致死性缺血性心、脑血管疾病等恶性临床事件。易损斑块发病机制及病理构成复杂且再发率高,口服抗凝、抗血脂类药物、介入及手术治疗均有各自局限性,难以作为安全、高效的治疗方法用于所有AS患者。因此,有必要研发出一种适用于全部AS患者的生物安全性高、治疗效果优异的治疗方式。
【主要发现】
本研究成功构建基于介孔MnO2的负载DATS的金属有机超分子笼MOC-68的AS纳米药物DMM。研究发现DMM可以持久、高效装载理化性质不稳定的外源性H2S气体供体DATS,并通过靶向AS斑块微环境响应性释放H2S及O2,减轻细胞内炎症反应、抑制巨噬细胞迁移及吞噬ox-LDL诱导的泡沫化过程。同时可以解离出的Mn2+使AS治疗效果可以通过MRI实时监测,并且能通过微环境响应性缓释延长MR成像窗口,并具备良好的生物相容性与安全性。
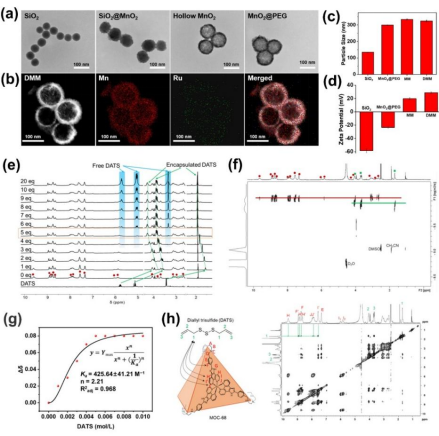
基于MOC-68的纳米材料DMM的表征及主客体研究
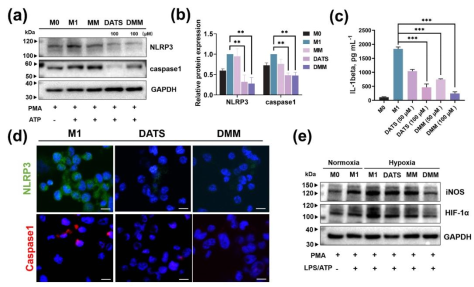
纳米材料DMM在体外治疗效果
![]()
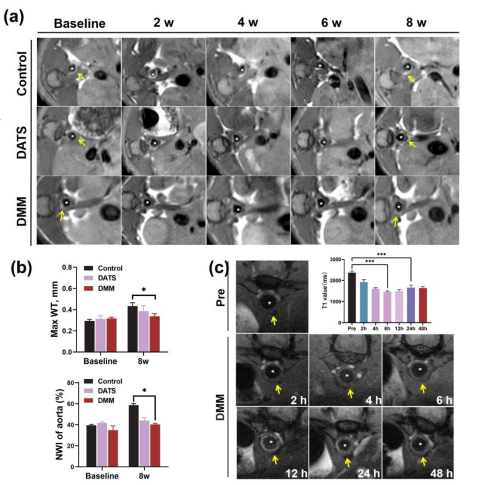
MR成像评估斑块微环境响应及活体治疗效果
【研究意义】
目前AS领域的纳米材料研究绝大多数都是围绕对AS的影像诊断效能及提高药物的装载效率,并没有充分发挥纳米医学材料微环境响应等多功能优势。本研究构建全新AS纳米治疗药物可以高效定量装载不稳定小分子药物、靶向斑块微环境响应性释放,增强病变部位的抗炎治疗效率减少毒副作用,同时实现改善乏氧,增效抗炎并利用MR连续动态监测治疗效果。本研究为AS的诊疗一体化提供了新方法,促进了纳米医学在AS等炎性疾病领域的研究与应用。

AS诊疗一体化研究示意图
【论文链接】
https://onlinelibrary.wiley.com/doi/10.1002/smll.202402673
【阅读二维码】
![]()







 粤公网安备 44010402003003号
粤公网安备 44010402003003号 