罗曼莉团队揭示长非编码RNA SVIL-AS1抑制AKT1 E17K突变蛋白去磷酸化维持AKT1E17K促癌功能新机制在Advanced Science发表
论文题目:AKT1E17K-Interacting lncRNA SVIL-AS1 Promotes AKT1 Oncogenic Functions by Preferentially Blocking AKT1E17K Dephosphorylation.
通讯作者:罗曼莉
第一作者:王静怡;陈文颖
论文发表刊物:Advanced Science
|
|
【研究背景】
PI3K-AKT通路的异常激活是肿瘤发生的重要驱动因素,AKT1的E17K突变与多种肿瘤的发生发展相关。已有报道AKT1E17K突变通过增强与细胞膜的结合,促进AKT1磷酸化和激活。以往的研究主要集中于 AKT1E17K 的致癌机制,然而AKT1E17K磷酸化状态的动态调控仍不清楚。同时,AKT1E17K突变肿瘤对PI3K-AKT通路抑制剂不敏感,解析AKT1E17K动态调控机制,将有望为AKT1E17K突变肿瘤的治疗提供理论依据和新的治疗策略。
【主要发现】
本研究筛选与野生型和E17K突变型AKT1蛋白结合的 lncRNA,鉴定出 SVIL-AS1 是特异结合AKT1E17K突变蛋白的lncRNA。敲低SVIL-AS1可显著抑制AKT1E17K突变细胞在体内外的生长。SVIL-AS1竞争性结合磷酸酶PP2A全酶的亚基 PPP2R2A,阻断其与AKT1E17K突变体的相互作用,从而抑制AKT1去磷酸化。SVIL-AS1在乳腺癌组织中高表达,并与AKT1磷酸化水平和患者不良预后相关。沉默SVIL-AS1可增强AKT1E17K突变细胞对PI3Ka抑制剂和AKT1变构抑制剂的敏感性。
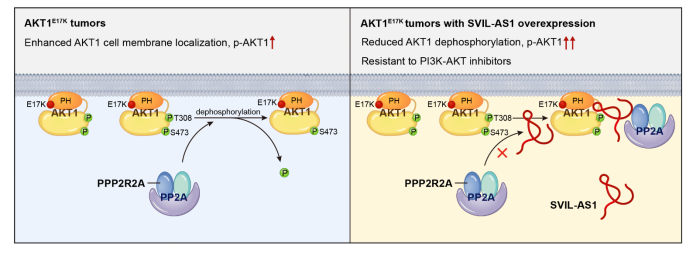
【研究意义】
本研究首次报道lncRNA可结合肿瘤中的热点突变蛋白并调控其功能,阐明SVIL-AS1维持AKT1E17K突变蛋白持续激活的关键作用,揭示了AKT1去磷酸化调控的新机制,鉴定出PI3K-AKT这一肿瘤重要信号通路调控网络的新成员。本研究不仅发现SVIL-AS1可作为AKT1E17K突变肿瘤的治疗靶点,还提出靶向SVIL-AS1联合PI3Ka抑制剂或AKT1变构抑制剂,治疗AKT1E17K突变肿瘤的新策略。
论文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202500919
阅读二维码:








 粤公网安备 44010402003003号
粤公网安备 44010402003003号 