陈旭/林天歆团队开发基于CRISPR系统的工程化细菌外膜囊泡增强T细胞免疫以促进肿瘤免疫治疗的研究在《Advanced Materials》杂志发表
论文题目:Engineering CRISPR System-Based Bacterial Outer Membrane Vesicle Potentiates T Cell Immunity for Enhanced Cancer Immunotherapy
通讯作者:陈旭、林天歆等
第一作者:汪洪津、詹恒基、潘柏林
论文发表刊物:Advanced Materials

【研究背景】
肿瘤免疫治疗是通过激活人体免疫系统来精准识别和杀伤肿瘤细胞的治疗方法。免疫治疗的主要方式包括免疫检查点阻断(ICB)治疗、过继性细胞转移疗法、肿瘤疫苗和细胞因子疗法等。迄今为止,免疫检查点阻断治疗是最有效和应用最为广泛的免疫治疗方法。以 PD-1和PD-L1抑制剂为代表的免疫检查点抑制剂显著改善肿瘤病人的生存和生活质量,取得了较好的临床获益,已成为包括黑色素瘤、非小细胞肺癌等在内的多种晚期实体肿瘤的标准一线治疗方案。然而,ICB疗法的总体治疗效果仍然非常有限,应答率仅有20%-30%,尤其是在缺乏免疫浸润的“冷肿瘤”中,其核心瓶颈在于肿瘤微环境中T细胞浸润不足及功能抑制。因此,开发能够重塑免疫微环境并促进效应T细胞趋化和激活的新型免疫治疗方法和联合疗法,进而逆转ICB治疗抵抗,具有重要的临床意义和科学价值,也是肿瘤免疫治疗领域亟需解决的关键问题。
【主要发现】
本研究首先筛选到BL21(DE3)来源OMV具有最佳的肿瘤抑制和免疫激活能力,可作为后续工程化改造的基础OMV。进一步通过将CRISPR-dCas9系统与OMV外膜蛋白ClyA融合表达,开发出一种多功能的OMV递送平台。这些工程化OMV能够自包装和递送多种基因,显著提高基因富集效率。在此基础上,本研究进一步构建了携带两种免疫激活因子CXCL9和IL12编码基因的新型OMV递送系统OMV-C9I12,通过重塑肿瘤免疫微环境,介导T细胞趋化和激活,进而放大OMV的免疫激活效应,提高其抗肿瘤活性。本研究通过构建多种鼠源性和人源化的临床前肿瘤模型,证实工程化OMV-C9I12系统在体内有效促进了T细胞的浸润和激活,并能够增敏ICB治疗,且对小鼠无明显毒副作用。机制上阐明OMV-C9I12通过促进CXCL9和IL12分泌,显著上调免疫细胞中JAK-STAT和NF-κB等信号通路,促进免疫应答基因表达,从而介导T细胞免疫。
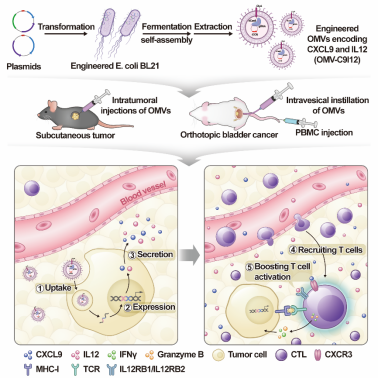
【研究意义】
本研究通过构建低成本和模块化的多功能OMV递送平台以及在多种肿瘤模型中的功能和机制验证,为促进肿瘤基因治疗和克服免疫治疗抵抗等临床问题提供新策略,为未来临床转化应用提供理论基础。
论文链接:
https://pubmed.ncbi.nlm.nih.gov/40495695/
阅读二维码:








 粤公网安备 44010402003003号
粤公网安备 44010402003003号 