【临床研究设计部】人类遗传资源行政审批的申报指南
一、适用范围
本指南适用于我院研究者发起的临床研究人类遗传资源管理。所称人类遗传资源包括人类遗传资源材料和人类遗传资源信息。人类遗传资源材料是指含有人体基因组。基因等遗传物质的器官、组织、细胞等遗传材料。人类遗传资源信息是指利用人类遗传资源材料产生的数据等信息资料。
研究者发起的临床研究在开展涉及人类遗传资源采集、保藏、利用、对外提供过程中应当遵守《中华人民共和国人类遗传资源管理条例》(国令第717号)、《中山大学孙逸仙纪念医院人类遗传资源管理办法》的相关规定。项目须在获得中国人类遗传资源管理办公室批准或备案后方可启动开展。
人类遗传资源采集活动,包括重要遗传家系(患病家系或具有遗传性特殊体质或生理特征成员五人以上,涉及三代)、特定地区人类遗传资源和国务院科学技术行政部门规定种类(罕见病、具有显著性差异的特殊体质或生理特征的人群)、数量(累积500人以上);国际合作科学研究,是指与外国组织及外国组织、个人设立或者实际控制的机构(称外方单位)合作进行的科学研究活动;信息对外提供或开放使用,指的是将人类遗传资源(以下简称人遗)向外国组织、个人及其设立或者实际控制的机构提供或开放使用。
二、办理方式
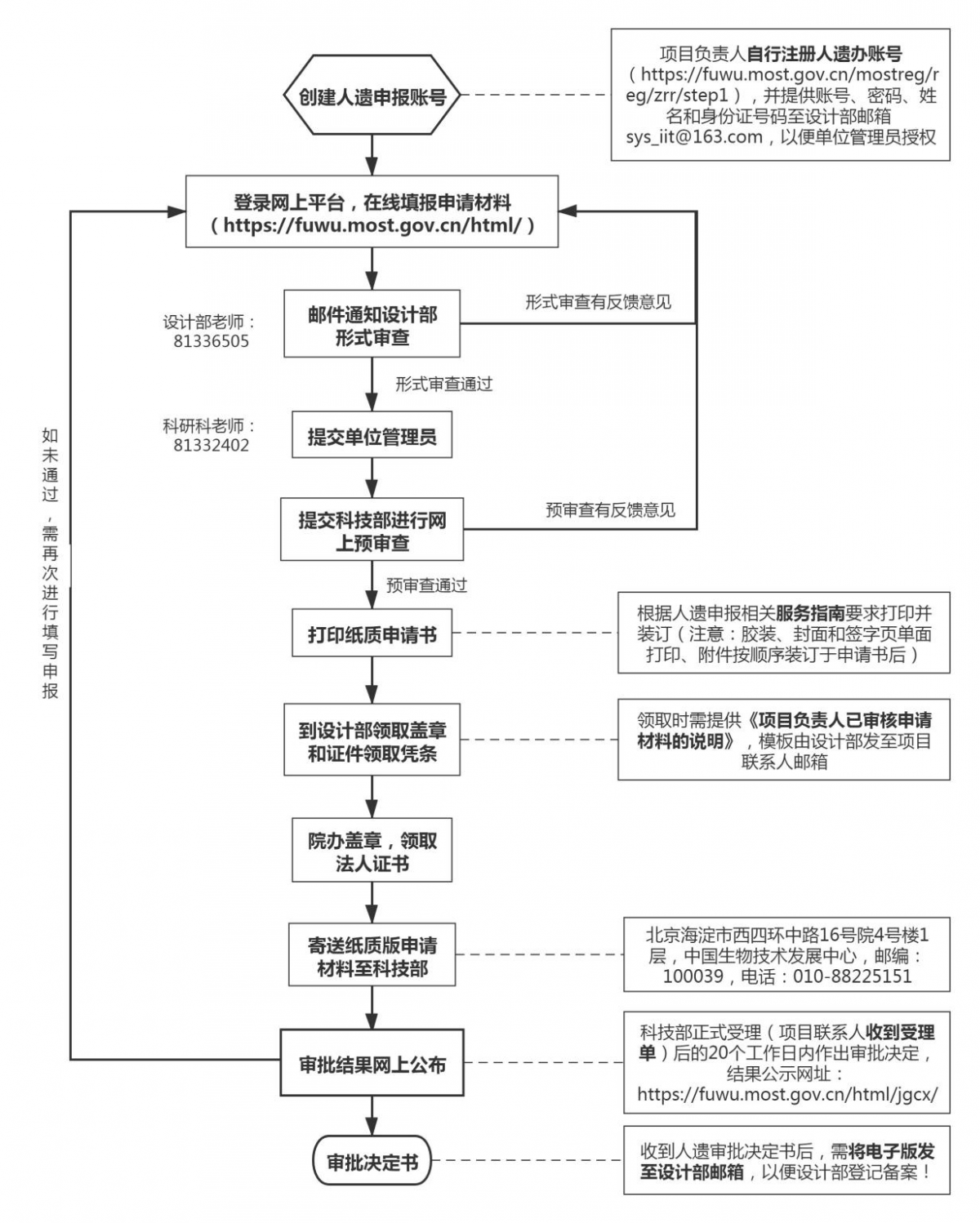
(一)创建账号
项目负责人自行在科技部网址注册账号(科技部网址:https://fuwu.most.gov.cn/mostreg/reg/zrr/step1)。注册成功后提供账号名称及密码、项目负责人姓名和身份证号码至临床研究设计部(以下简称设计部)邮箱(sys_iit@163.com),邮件主题命名为“项目负责人-人遗申报账号授权”。单位管理员对账号进行授权后,方可在网上平台进行申报填写。
(二)网上申请
项目负责人登录人遗申报账号,进入网上平台-服务事项-采集审批/国际合作科学研究审批/信息备份及备案页面,填写项目信息。(网址:https://fuwu.most.gov.cn/authentication/sso/login)。采集审批和国际合作科学研究审批申报的注意事项见附件(附件2、3)(供参考)。
(三)设计部形式审查
为提高设计部审查和研究者修改的效率,项目负责人完成填写后,暂不提交单位管理员,邮件通知设计部进行形式审查,邮件主题命名为“项目负责人-项目简称-人遗申报-申报类型(如采集、国合、信息备份备案等)”。形式审查时间为2-5个工作日,形式审查通过后方可进一步提交单位管理员。如形式审查有反馈意见,需根据反馈意见进行修改填写并再次通知设计部进行形式审查。
(四)科技部预审查
项目通过形式审查后即可提交单位管理员,由单位管理员进一步将审批项目提交至国家科技部。科技部收到在线提交的电子版申请材料后将进行预审查,预审查时间为5个工作日。项目通过预审查后方可打印纸质材料;若预审查不通过,则需要根据科技部预审查意见进行相应修改和补充,修改后暂不提交单位管理员并且再次邮件通知设计部进行形式审查。
(五)纸质版申请材料递交
项目通过科技部预审查后,项目负责人根据《服务指南要求》打印纸质版申请材料(服务指南的下载网址:https://fuwu.most.gov.cn/html/jcxtml/20181201/2837.html?tab=fwzn)。打印的一般要求:A4纸双面打印、封面和签字盖章页单面打印、一式一份、胶装,附件按照顺序装订于申请书之后。
项目负责人携带纸质版申请材料以及《项目负责人审核说明》(见附件1)到设计部领取盖章和证件领取凭条,凭凭条至院长办公室(中山楼9楼)盖单位公章,扫描并上传单位盖章页至科技部申报网站,而后向科技部寄送纸质申请材料,寄送地址:北京海淀市西四环中路16号4号楼1层,中国生物技术发展中心。
(六)科技部审批决定
科技部收到纸质申请材料后,在5个工作日内完成形式审查,对申请材料齐全、符合规定形式的申请,予以正式受理并出具受理单,否则予以退回处理。科技部在正式受理后的20个工作日作出批准或不予批准的决定。审批结果在科技部网站公布(网址:https://fuwu.most.gov.cn/html/jgcx/)。
审批不通过的项目需重新进行申报。项目负责人需在邮件中说明“申报的次数及上次不通过原因”。
(七)设计部管理
获得人类遗传资源行政审批的项目,在完成合同签署(如需)、clinicaltrial注册和医学研究登记备案系统备案后,应根据“正式立项文档清单”(见立项指南附件),将相应资料的电子版发至设计部邮箱,进而完成设计部备案及正式立项等事宜。
三、申报流程
研究者发起的临床研究人类遗传资源申报流程图:
四、咨询途径
(一)办公室咨询:北院岭南楼26楼临床研究设计部(地址:广州市越秀区沿江西路107号)
(二)电子邮件咨询:sys_iit@163.com
(三)电话咨询:020-81336505、020-81332120
五、其他注意事项
指南中所涉及附件请参见我院OA文件,具体路径:OA首页(下拉)→单位文档→临床研究中心文档(全院可见)→【临床研究设计部】工作指南→研究者发起的临床研究人类遗传资源行政审批的申报指南。







 粤公网安备 44010402003003号
粤公网安备 44010402003003号 