科学研究
黄林团队揭示含两个不同配体结合口袋的NAD+-II核糖开关的晶体结构及作用机制,相关研究结果在Nucleic Acids Research杂志发表
发布日期:2023-10-07
论文题目:Crystal structures of the NAD+-II riboswitch reveal two distinct ligand-binding pockets
通讯作者:黄林 等
第一作者:彭雪梅
论文发表刊物:Nucleic Acids Research

【研究背景】
核糖开关(Riboswitch)一般是细菌mRNA上5’UTR区存在的一种保守的特征性结构。它可通过特异性结合配体(一般为小分子代谢物、信号分子、金属离子、氨基酸等)引起RNA构象改变,进一步通过调控转录、翻译、剪切或mRNA稳定性等生物学进程影响下游基因表达。2021年,Breaker实验室利用序列比对分析发现一段位于pnuC基因上游的结构性RNA,并命名为pnuC motif。后续实验表明pnuC motif极有可能是第二类识别NAD+的核糖开关,即NAD+-II核糖开关。
【主要发现】
本研究利用X-射线晶体学的方法,解析了3种不同序列以及3种不同配体组合的5个复合物晶体结构,最高分辨率达1.67Å(图1)。从结构可知,NAD+-II核糖开关主要识别NAD+的NMN部分,且每个NAD+-II核糖开关分子有两个配体识别位点,形成两个空间位置完全不同的结合口袋。课题组进一步利用温控Native Gel验证了这两个结合位点都能稳定NAD+-II核糖开关的翻译关闭状态。
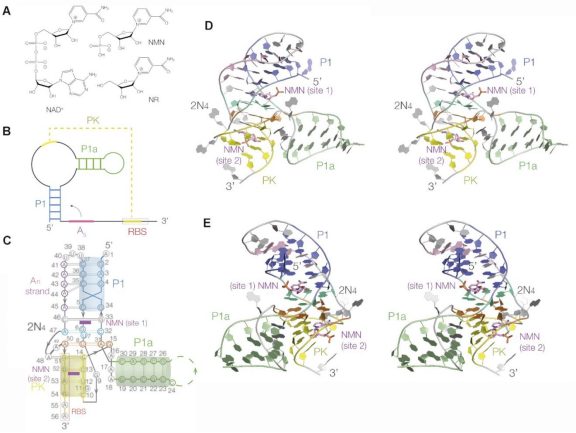
图1
【研究意义】
本项研究成功解析了NAD+-II核糖开关与NAD+、NMN、NR的多个复合物晶体结构,揭示了一种新型的由单个适配体域结合两个小分子配体的核糖开关结构。进一步根据三维结构特征,利用温控Native Gel验证了结合位点处关键碱基突变对NAD+-II核糖开关整体构象的影响。本工作展示了RNA和小分子相互作用以及小分子调控RNA功能的的多样性,为今后开发靶向RNA的小分子药物等研究方向提供了理论基础与实验依据。
论文链接:
https://doi.org/10.1093/nar/gkad102
阅读二维码:

相关资讯
2025-11-21







 粤公网安备 44010402003003号
粤公网安备 44010402003003号 