许小丁教授团队发现纳米粒子介导的lncBCMA沉默可以促进eEF1A1泛素化抑制乳腺癌生长和转移的研究机制,相关研究成果在Acta Pharmaceutica Sinica B杂志发表
论文题目:Nanoparticles (NPs)-mediated lncBCMA silencing to promote eEF1A1 ubiquitination and suppress breast cancer growth and metastasis
通讯作者:许小丁;姚和瑞;聂燕
第一作者:杨科;徐磊;许英
论文发表刊物:Acta Pharmaceutica Sinica B

【研究背景】
据估计约 40% 的乳腺癌患者发生转移,总体 5 年生存率低于 30%。长非编码RNA(lncRNA)是长度超过 200 个核苷酸 (nt) 的 RNA 转录物的一种亚型,可以通过转录或转录后调节目标基因的功能,在癌症转移中发挥重要作用。探索与转移相关的功能性的lncRNA并阐明其在调节癌症发生和进展中的生物学功能具有重要的意义。更重要的是,尽管目前发现的lncRNA的重要性和调控机制已被广泛探索,但由于缺乏有效的体内调节lncRNA功能的策略,很少有成功转化为临床应用。
【主要发现】
在此,许小丁教授研究团队鉴定了一种新的功能性lncRNA(记为lncBCMA),它能够稳定真核翻译延伸因子1A1(eEF1A1)的表达,拮抗其泛素化,从而促进三阴性乳腺癌(TNBC)的生长和转移。基于这种调节机制,该研究团队设计了一个内体 pH响应纳米颗粒(NP) 平台,用于系统性 lncBCMA siRNA(siBCMA)的递送。这种NPs介导的siBCMA递送可以有效沉默lncBCMA表达并促进eEF1A1泛素化,从而显着抑制TNBC肿瘤的生长和转移。
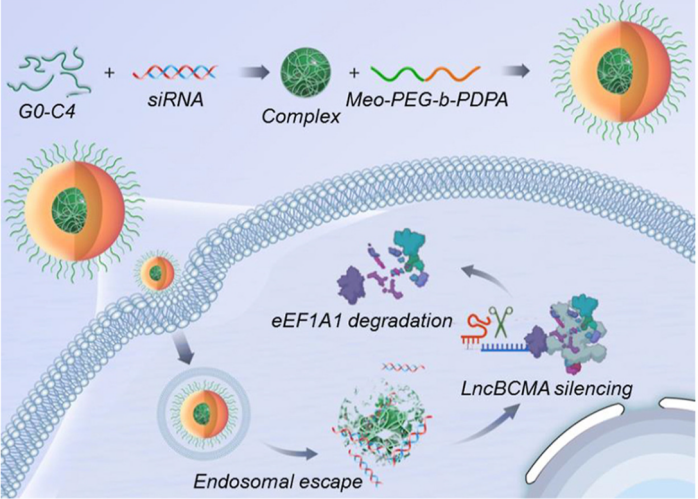
【研究意义】
该文章发现了一种全新的lncRNA,lncBCMA高表达可通过拮抗eEF1A1泛素化增强eEF1A1稳定性,从而促进TNBC细胞的增殖、迁移和侵袭。lncBCMA可以作为预测TNBC患者预后的潜在生物标志物,并且NPs介导的lncBCMA沉默可能是转移性TNBC治疗的有效策略。
论文链接:
https://www.sciencedirect.com/science/article/pii/S2211383522004981
阅读二维码:








 粤公网安备 44010402003003号
粤公网安备 44010402003003号 