【临床研究设计部】研究者发起的临床研究Clinical trial注册指南
获得国际上公认临床研究注册网站的注册号是发表临床研究论文的必要条件。现阶段公认的临床研究注册网站包括2个,建议首选clinical trial网站进行注册。
(一)Clinicaltrial(www.clinicaltrials.gov)
(二)中国临床试验注册中心(www.chictr.org.cn)。
一、适用范围
所有临床研究项目,尤其是研究者发起的临床研究(不以药品、医疗器械注册为目的),均应在项目启动前完成网站注册,未在注册网站进行注册的项目,不予正式立项。多中心临床研究由组长单位进行注册即可,参与单位无需重复注册。若在研究过程中更改方案,组长单位应及时更新网站注册信息。
二、研究注册具体流程
(一)注册系统网址
注册系统网址为:https://clinicaltrials.gov
(二)获取注册系统账号
所有申请注册的临床研究项目负责人需提前准备好伦理审查批件。未有注册登录账号的,需将以下邮件信息发送至设计部邮箱 sys_iit@163.com, 申请开通注册登陆账号:
1、项目伦理批件
2、研究方案
3、项目负责人信息:姓名、邮箱地址、联系电话;
(三)添加注册临床研究项目流程
1、获取账号后,按照网址登陆。登陆界面如下
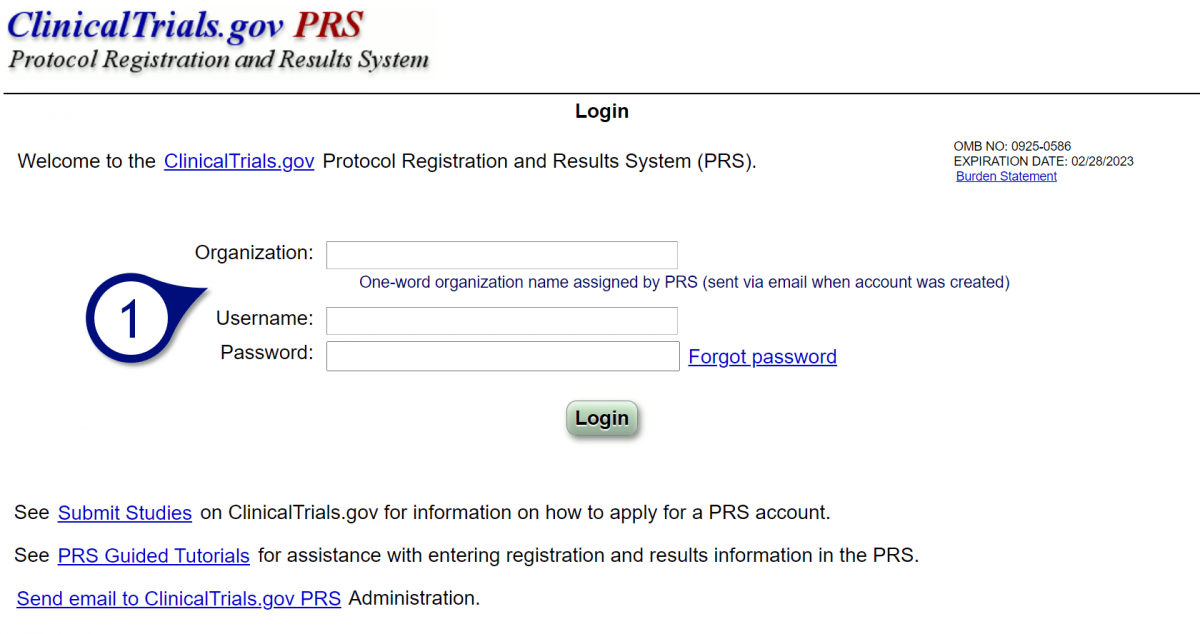
图1. 登录界面
2、点击Quick Links里的“New Record”或从Record下拉菜单中选择“New Record”

图2. 创建新记录页面
3、为避免重复或无效注册您的研究,请确认“Create New Record”页面查看提示(1-5)。
4、输入“Organization’s Unique Protocol ID ”,为项目对应伦理批件号。
5、输入“Brief Title”,是“Official Title”官方标题的简略版本。标题应告知读者正在研究的情况和治疗方法。
6、输入研究的缩写(如果适用)。
7、为“Study type”选择相应的单选按钮选项。数据元素因所选研究类型而异:干预性、观察性和扩大访问。
8、单击“Continue”按钮。

图3. 填写新记录相关信息
9、填写项目相关信息。具体请参考ClinicalTrials.gov Protocol Registration Data Element Definitions for Interventional and Observational Studies.
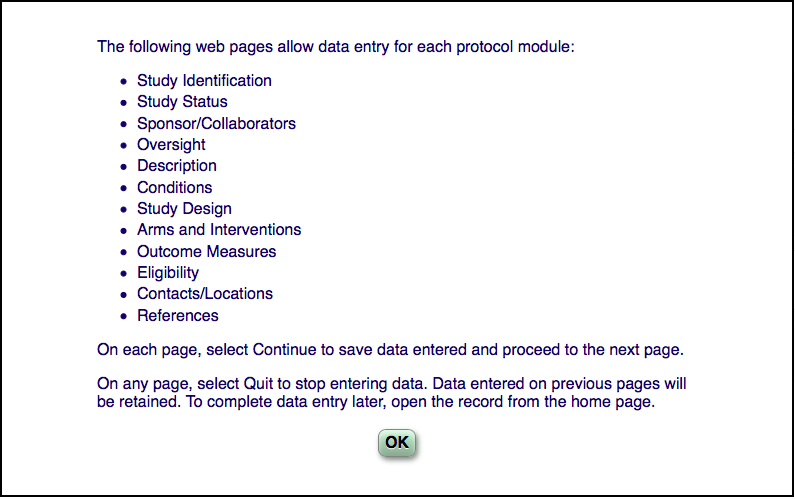
图4. 项目相关信息列表
10、项目负责人完成项目填写In Progress后,点击Entry Complete提交至设计部管理人员的审核,审核通过后提交至网站PRS管理人员最终审核。审核要点参见ClinicalTrials.gov Protocol Registration Quality Control Review Criteria 。通过审核后,即可获得相应研究注册号。如若发现问题,即会被退回至In Progress过程。具体流程,参见下图:
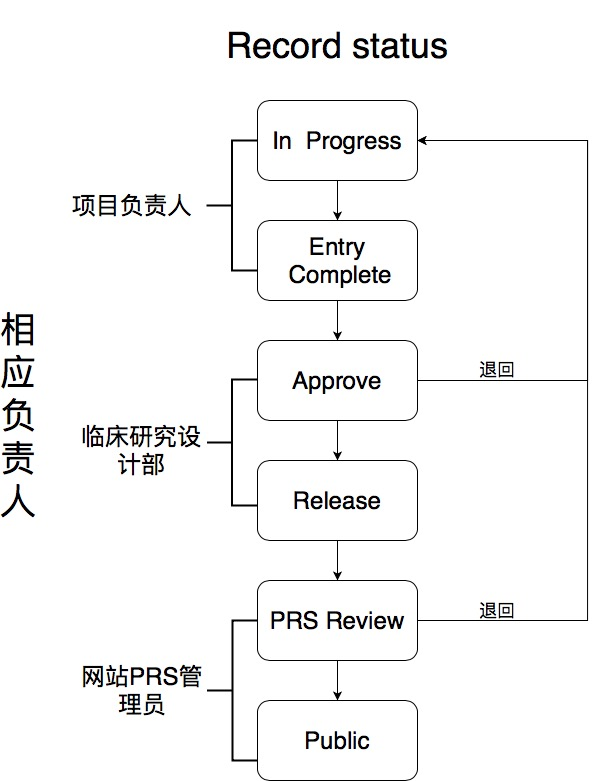
图5. clinical trial注册流程图
(四)注意事项
1、NCT注册完成后,请尽量避免修改方案,以免降低研究结果可靠性,影响研究结果发表。
2、需定期(每6个月或12个月)更新研究状态。
更多常见问题,可参考clinical trial网站“Frequently Asked Questions”。







 粤公网安备 44010402003003号
粤公网安备 44010402003003号 