【临床研究设计部】研究者发起的临床研究项目国家医学研究登记备案信息系统备案指南
根据国家《医疗卫生机构开展研究者发起的临床研究管理办法》《涉及人的生物医学研究伦理审查办法》等有关规定,涉及人的生物医学研究在实施启动前需进行医学研究备案工作。为了规范我院研究者发起的临床研究项目,结合国家医学研究登记备案系统(以下简称“备案系统”)中的备案程序,制定本指南。
一、适用范围
本指南仅限于研究者发起的临床研究项目,未备案的项目,不予正式立项。多中心临床研究由组长单位进行备案即可,参与单位无需重复备案。
二、备案具体流程
(一)备案系统网址
备案系统网址为:https://www.medicalresearch.org.cn/login
(二)获取备案信息系统账号
账号由我院临床研究设计部管理员创建。对于研究者发起的临床研究,初次创建账号需发送项目负责人姓名,身份证号,邮箱以及手机号发至临床研究设计部邮箱:sys_iit@163.com。临床研究设计部将在2个工作日内通过邮件回复账号及密码。
(三)添加备案临床研究项目流程
网站提供使用指南,如“项目负责人临床研究项目填报说明”“项目填报内容解释”“常见操作问题”等,具体可见网址:https://www.medicalresearch.org.cn/guide/index。一般流程如下:
1、获取账号后按照网址登录,首次登陆的研究者请点击左侧“个人信息”栏完善个人信息,登陆体界面如下:
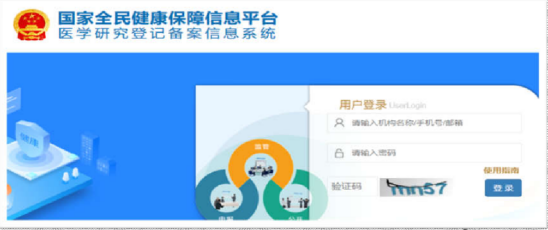
图 1 系统登陆首页
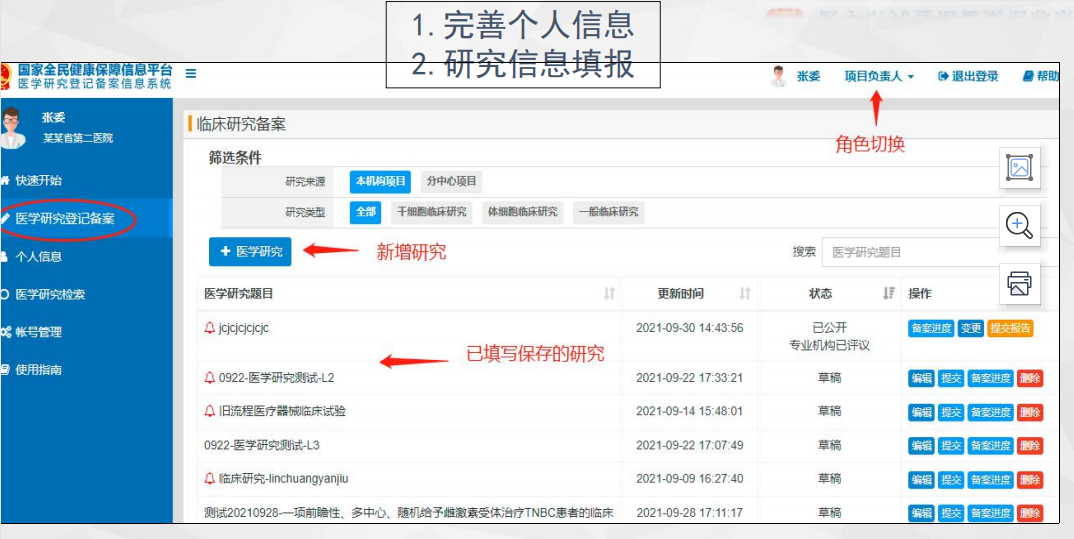
图 2 完善个人信息及临床研究备案角色切换界面
2、组长单位项目备案流程
(1)选择左侧“医学研究备案”栏目点击本机构项目后添加医学研究(具体界面如图3);已添加过的项目可在临床研究项目备案栏中查看。
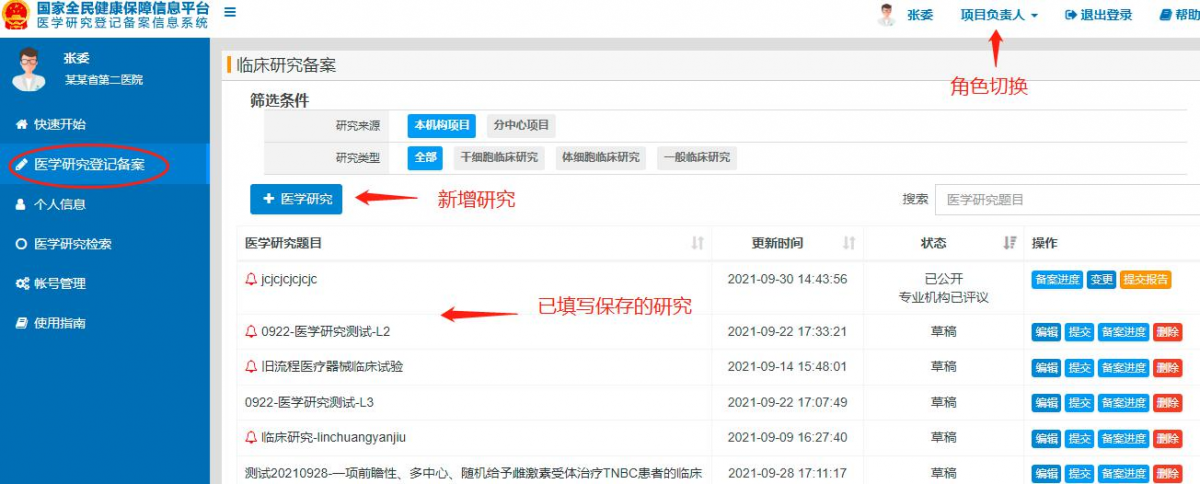
图3.医学研究新增项目界面
(2)创建备案项目后“临床研究项目新增”栏目分为基本信息、实施信息、研究内容、研究设计、招募信息、其他信息、数据共享与信息公开、相关附件共8个模块组成(具体界面及注意要点如图4-13),按照方案设计逐项进行填写,每填一个模块后可选择保存,保存后可再次编辑,标记*为必填项。相关附件栏需要上传研究的方案和知情同意书,仅支持PDF格式。
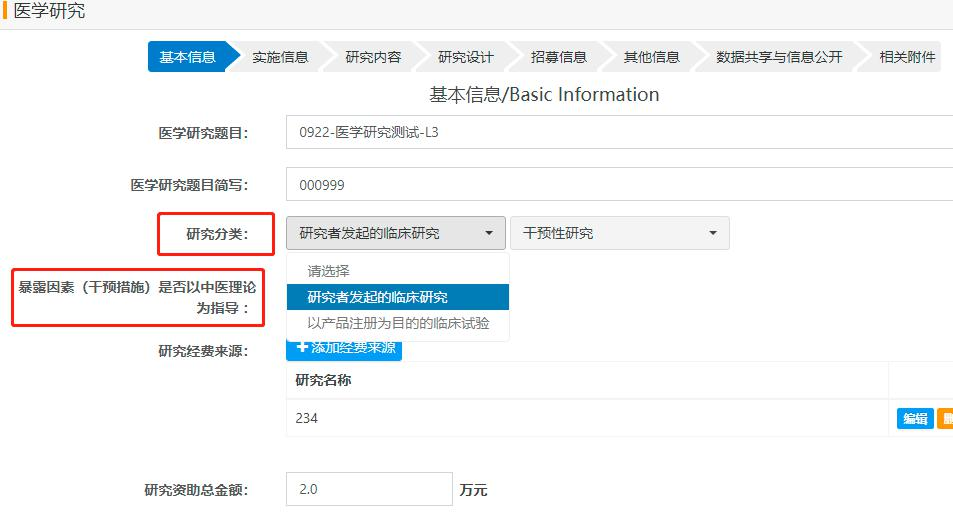
图 4 系统八大模块示意
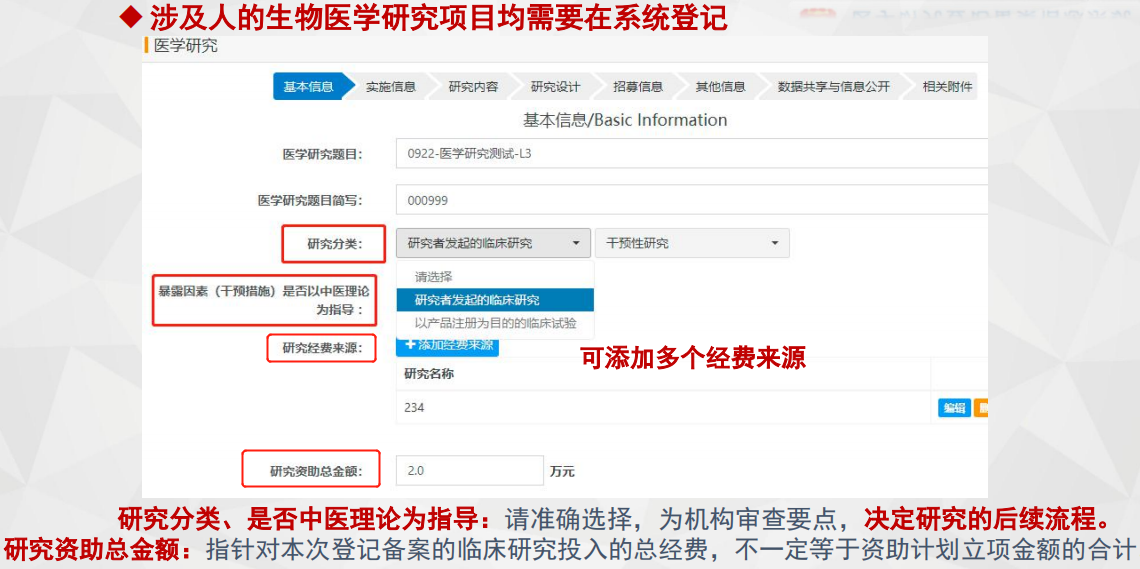
图5“基本信息”界面及注意要点
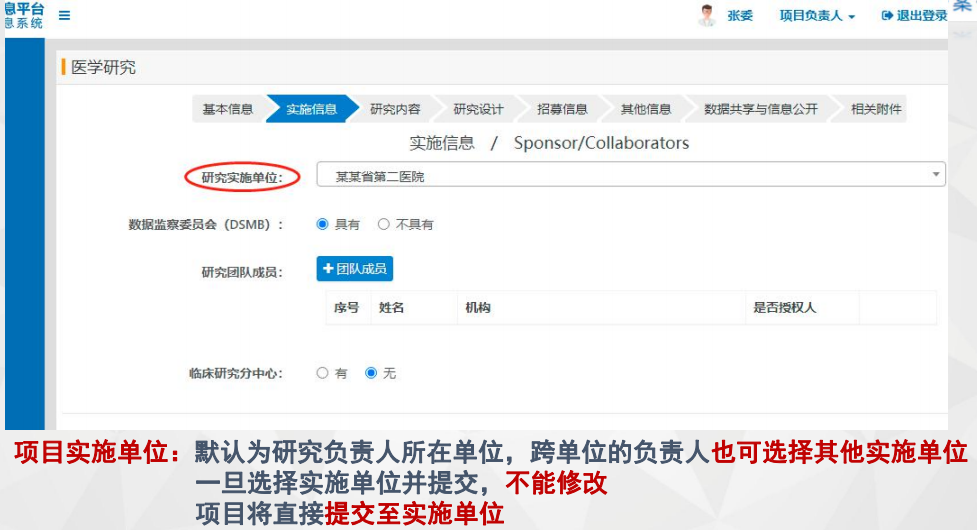
图6“实施信息”界面及注意要点1
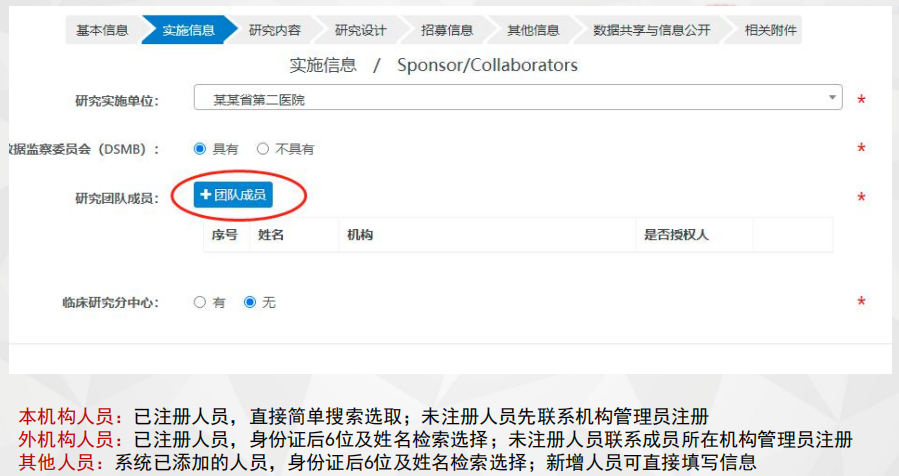
图7“实施信息”界面及注意要点2
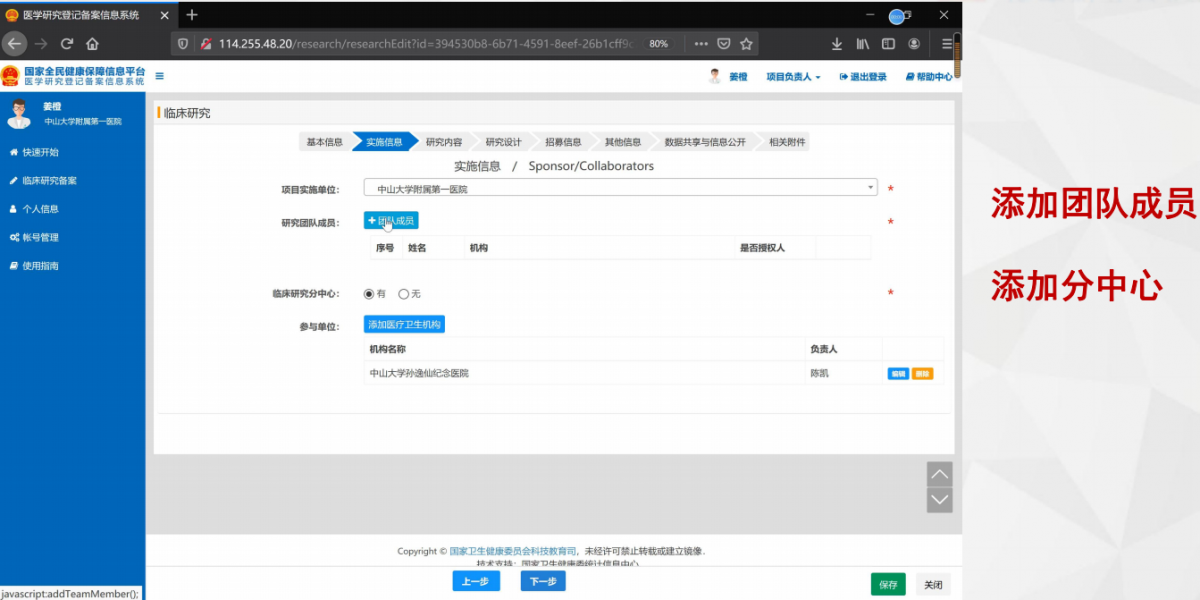
图8“实施信息”界面及注意要点3
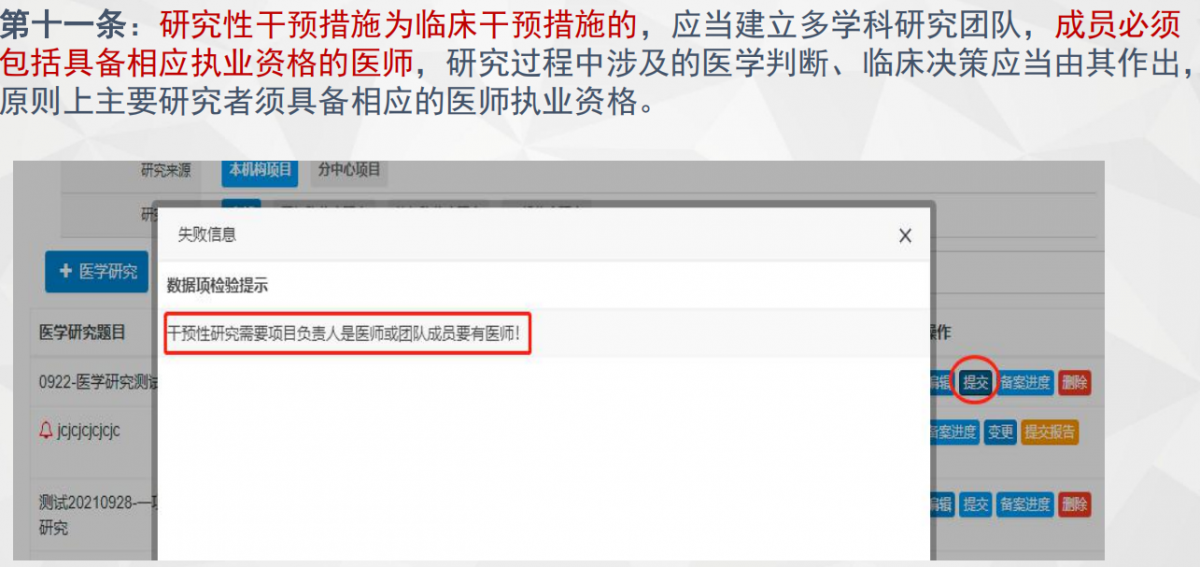
图9“实施信息”界面及注意要点4
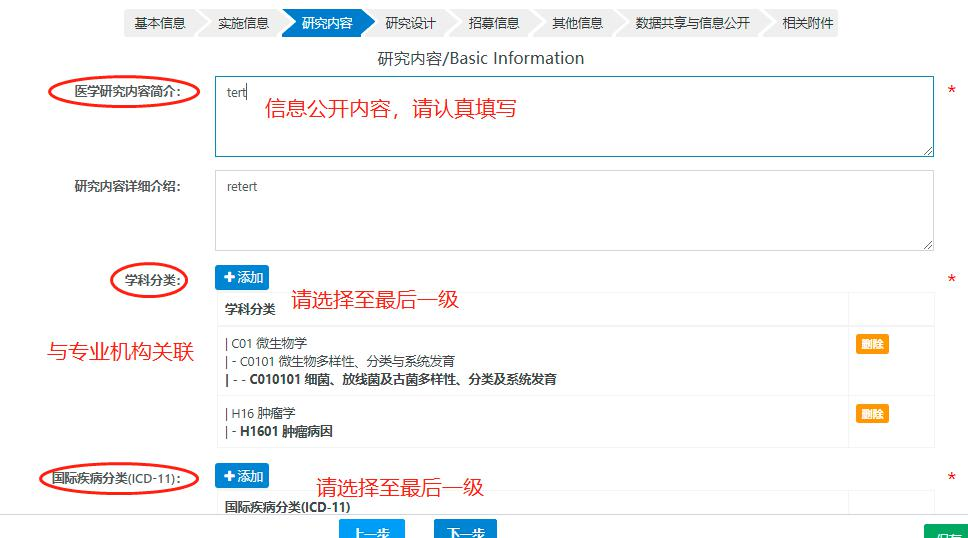
图10“研究内容”界面及注意要点
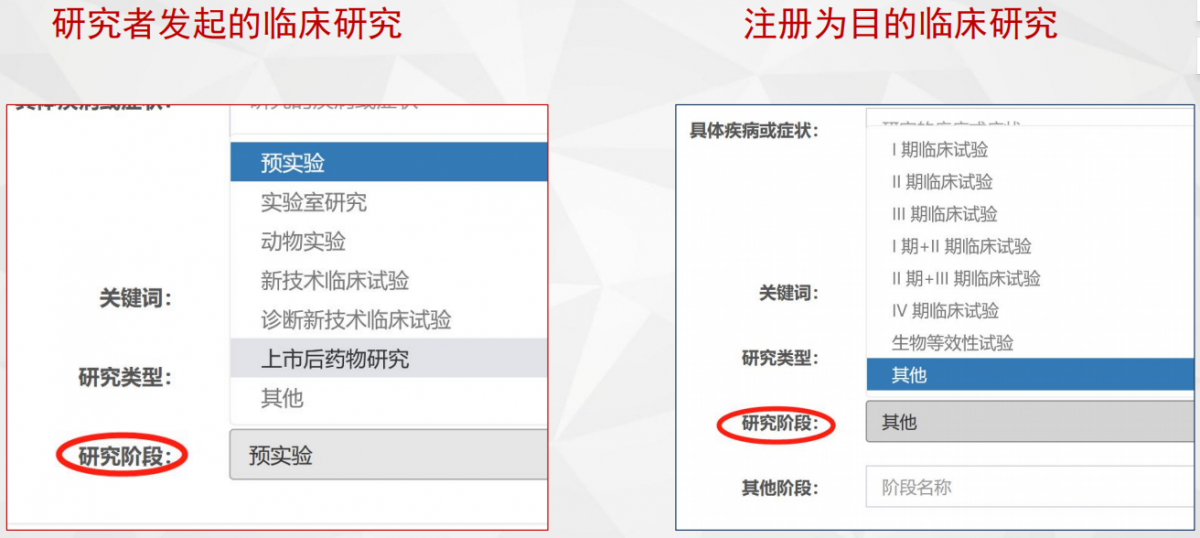
图11研究内容”模块研究者发起研究的临床研究和注册为目的的临床研究填写界面

图12“研究设计”界面干预措施填写注意事项
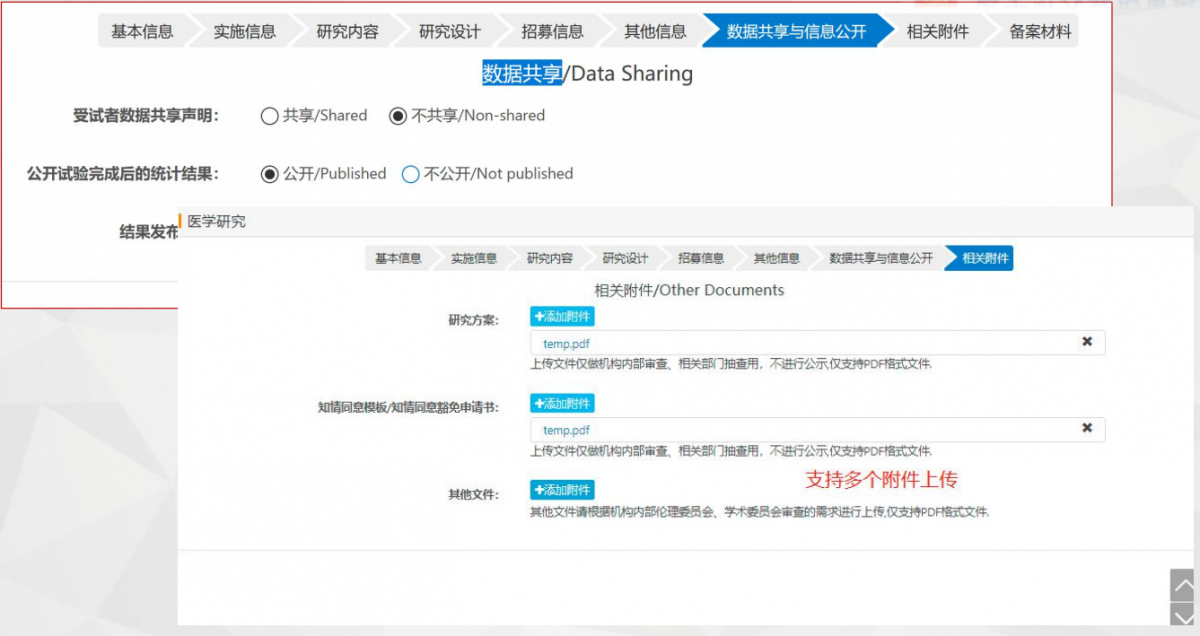
图13“数据共享与信息公开”界面干预措施填写注意事项
(3)填写完整保存后提交
研究者发起的临床研究均需提交至科学性审查
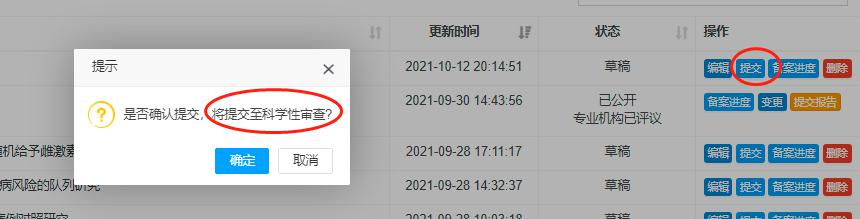
图14. 提交至科学性审查
项目负责人提交信息后,请及时跟进项目备案状态,或根据各节点意见,按要求修改提交资料。如有疑问,请联系对应的联系人:学术委员会——联系人:王老师,联系电话:020-81332402;伦理委员会——联系人:区老师,联系电话:020-81332587;机构管理员——联系人:冼老师(观察性项目)、贾老师(干预性项目),联系电话:020-81336505。
3、多中心研究备案
原则:多中心研究由组长单位负责登记备案,分中心予以确认并提交分中心伦理批准材料。
注意:多中心研究须与合作研究进行区分,多中心项目的研究方案各中心相同,只需要一个牵头单位备案,提供统一方案。
合作研究是合作各方负责不同的研究内容,研究方案不同,所有涉及人的生物医学研究的合作方都需要单独在系统进行项目备案。
4、关于忘记密码
(1)通过邮箱找回(推荐使用)
到备案系统首页(https://www.medicalresearch.org.cn/login),点击“忘记密码”,通过邮箱找回。
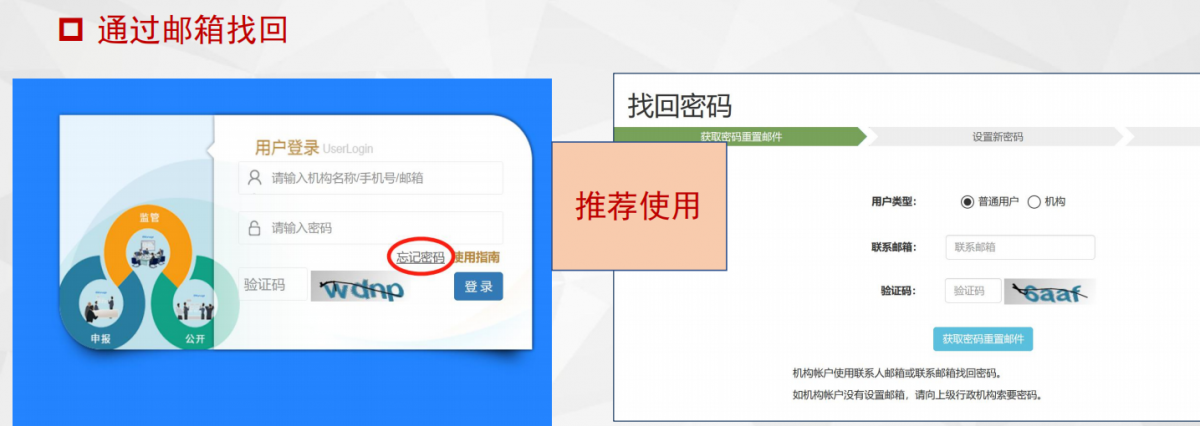
图15. 邮箱找回密码







 粤公网安备 44010402003003号
粤公网安备 44010402003003号 